3.
Sikloalkana (disebut juga naftena - jangan terbalik dengan naftalena) adalah sebuah tipe alkana yang mempunyai satu atau lebih cincin atom karbon pada struktur kimia molekulnya. Alkana sendiri merupakan senyawa organik hidrokarbon yang hanya mempunyai ikatan kimia tunggal pada struktur kimianya.
Sikloalkana adalah golongan senyawa hidrokarbon jenuh yang rantai atom-atom karbon-karbonnya tertutup (membentuk cincin), sehingga termasuk hidrokarbon siklik. Karena sifat-sifat sikloalkana sangat mirip dengan golongan alkana (hidrokarbon alifatik), maka sikloalkana dikategorikan sebagai hidrokarbon alisiklik. Rumus umum sikloalkana CnH 2n. Dengan pasangan-pasangan elektron yang saling berdekatan, terjadi tolak menolak antara pasangan-pasangan elektron yang menghubungkan atom-atom karbon. Ini membuat ikatan-ikatan lebih mudah terputus.
Bila sikloalkana mengikat substituen pada dua atau lebih atom karbon, maka terjadi isomer cis-trans. Salah satu contohnya adalah pada 1,2-dimetilsiklopentana. Dalam penggambaran strukturnya, cincin siklopentana digambarkan sebagai segilima datar, dengan ketentuan bila kedua substituennya terletak pada sisi yang sama dari bidang cincin dinamakan isomer cis, sedangkan bila berseberangan dengan bidang cincin dinamakan isomer trans. Pada sikloheksana juga dijumpai isomer-isomer cis-tans, yang bila digambarkan dengan konformasi kursi, yang masing-masing substituen dapat berposisi aksial atau ekuatorial.
Lalu, mengapa Cis1,3 lebih stabil dari pada sturktur trans-1,3 karena kedua substituen dalam cis-1,3 dapat berposisi ekuatorial. Sedangkan trans 1,3 satu gugus terpaksa berposisi aksial. Dalam hal ini kestabilan suatu isomer baik itu cis ataupun trans tergantung pada posisi substituennya. Jika cis 1,3 lebih stabil dikarenakanposisi ekuatorial hal ini disebabkan bahwa pada posisi ekuatorial efek tolakan steriknya lebih kecil dibandingkan posisi aksial pada trans1,3 sehingga cis-1,3 lebih stabil.
4.
Ketentuan Fischer (Konfigurasi Relatif)
Dengan mengunakan Proyeksi Fischer, sistem penggambaran konfigurasi gugus disekitar pusat kiral yang berbeda (susunan ruang atom atau gugus yang menempel pada karbon kiral), yaitu konvensi D dan L. Metode ini banyak digunakan dalam biokimia dan kimia organik terutama untuk karbohidrat dan asam amino.
Berikut ini proyeksi fischer untuk semua konfigurasi yang mungkin dari 2, 3, 4-pentanatriol. Dan pasangan-pasangan enantiomernya :
Senin, 10 Oktober 2016
RESUME PERTEMUAN KE-7 (KONFIGURASI MUTLAK / ABSOLUT DAN KONFIGURASI RELATIF, SERTA PEMISAHAN CAMPURAN RASEMIK)
Kiral berasal dari bahasa Yunani
"cheir" yang artinya tangan. Coba bayangkan tangan kiri berada di
depan cermin, tentu saja bayangannya adalah tangan kanan. Sekarang posisikan
tangan kiri dan tangan kanan menghadap ke bawah atau ke arah lantai. Kemudian letakan
tangan kiri di atas tangan kanan anda. Terlihat, tangan kanan tidak bisa
diimpitkan dengan tangan kiri kita.
Hal yang sama
juga berlaku bagi molekul-molekul organik tertentu. Pada gambar di atas, dapat
dilihat senyawa Alanine memiliki dua struktur yang berbeda. Sebutlah A dan B
yang analog dengan tangan kiri dan tangan kanan kita. A dan B sering disebut
sebagai stereoisomer (isomer ruang) atau isomer optis. Harus diingat, suatu
molekul organik disebut molekul kiral jika terdapat minimal satu atom C yang mengikat
empat gugus yang berlainan seperti senyawa Alanine. Molekul-molekul kiral
memiliki sifat yang sangat unik yaitu sifat
optis. Artinya suatu molekul kiral memiliki kemampuan untuk memutar bidang
cahaya terpolarisasi pada alat yang disebut polarimeter.
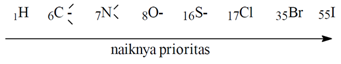
Menurut
Solomons (1990:112) menyatakan bahwa aturan
prioritas Chan-Ingold-Prelog yaitu prioritas ditentukan oleh nomor atom
dari atom yang terikat langsung dengan atom karbon yang berikatan. Jika atom
karbon yang terikat sama, maka yang digunakan sebagai dasar adalah atom yang
terikat berikutnya sampai diperoleh perbedaan prioritas yang terakhir yaitu
atom yang terikat oleh ikatan rangkap 2 atau 3 dianggap mengikat 2 atau 3 atom
sejenis dengan ikatan tunggal.
Sistem tata nama isomer
optik diperkenalkan Chan-Ingold-Prelog yang mengklasifikasikan atom C kiral
sebagai R atau S. Sistem tata nama
ini sering dinamakan konfigurasi
mutlak/absolut. Contohnya (2R,3S)-2,3 dibromo pentana. Dengan sistem tata
nama ini diperkenalkan dua klasifikasi stereoisomer, yaitu enantiomer dan
diastereoisomer. Enantiomer
adalah yang antara satu sama lain merupakan bayangan cermin. Diastereomer
adalah yang bukan merupakan bayangan cermin, contohnya adalah isomer cis dan
trans. Definisi dari enantiomer dan diastereoisomer
sedikit rumit tetapi akan dijelaskan secara sederhana.
- (2R,3S)-2,3 dibromo pentana dan (2S,3R)-2,3 dibromo pentana
- (2R,3S)-2,3 dibromo pentana dan (2R,3R)-2,3 dibromo pentana
Sekarang penjelasan berikut ini :
- Jika di antara sepasang stereoisomer tidak ada atom C kiral yang memiliki konfigurasi yang sama, maka stereoisomer tersebut adalah enantiomer. Seperti contoh pertama (2R,3S)-2,3 dibromo pentana dan (2S,3R)-2,3 dibromo pentana.
- Jika di antara sepasang stereoisomer terdapat minimal satu atom C kiral yang memiliki konfigurasi yang sama, maka stereoisomer tersebut adalah diastereoisomer. Seperti contoh kedua (2R,3S)-2,3 dibromo pentana dan (2R,3R)-2,3 dibromo pentana.
Cara
Menentukan Konfigurasi R/S :
1. Diurutkan keempat gugus atau atom
yang terikat pada atom C kiral, sesuai urutan prioritas aturan deret
Chan-Ingold-Prelog.
2. Diproyeksikan molekul itu sedemikian
sehingga gugus yang berprioritas rendah kebelakang.
3. Dipilih gugus dengan prioritas
tertinggi dan ditariklah satu anak panah bengkok ke gugus dengan prioritas
tertinggi berikutnya.
4. Jika panah ini searah jarum jam,
maka konfigurasinya adalah R, jika berlawanan arah konfigurasi S
Sebagian
masyarakat mungkin kurang memperhatikan sifat optis suatu senyawa organik,
padahal reaksi kimia dalam sistem biologis makhluk hidup sangat stereospesifik.
Artinya suatu stereoisomer akan menjalani reaksi yang berbeda dengan
stereoisomer pasangannya dalam sistem biologis makhluk hidup. Bahkan terkadang
suatu stereoisomer akan menghasilkan produk yang berbeda dengan stereoisomer
pasangannya dalam sistem biologis makhluk hidup.
Melihat fakta di
atas stereokimia (struktur ruang) suatu senyawa organik mutlak harus
diperhitungkan dalam reaksi-reaksi biologis makhluk hidup. Sayangnya sulit
sekali menghasilkan suatu enantiomer atau diastereoisomer murni. Bahkan 90
persen obat-obat sintetik yang mengandung senyawa kiral masih dipasarkan dalam
kondisi rasemik sampai awal 1990-an.
Campuran rasemik artinya suatu campuran
yang mengandung sepasang enantiomer dalam jumlah yang sama. Lalu bagaimana
caranya memperoleh suatu enantiomer dengan enantiomeric excess (EE) yang
tinggi? Enantiomeric excess artinya
persentase suatu enantiomer yang berkonfigurasi R dikurangi persentase
enantiomer pasangannya yang berkonfigurasi S dalam suatu campuran atau
sebaliknya. Harus diingat dua prinsip
dasar isomer optik yaitu:
- Sepasang enantiomer memiliki sifat-sifat fisika (titik didih, kelarutan, dan lain-lain) yang sama tetapi berbeda dalam arah rotasi polarimeter dan interaksi dengan zat kiral lainnya.
- Sepasang diastereoisomer memiliki sifat-sifat fisika dan sudut rotasi polarimeter yang berbeda satu sama lain. Bahkan sering dalam bereaksi mengambil cara yang berlainan. Artinya kita bisa memisahkan campuran dua diastereoisomer dengan cara-cara fisika (destilasi, kristalisasi, dan lain-lain). Akan tetapi tidak bisa memisahkan campuran dua enantiomer dengan cara-cara fisika, karena sepasang enantiomer memiliki properti fisika yang sama. Kesimpulannya, kita dapat dengan mudah memisahkan campuran dua diastereoisomer, tapi akan kesulitan memisahkan campuran dua enantiomer.
Lalu bagaimana
memperoleh suatu enantiomer dengan EE yang tinggi? Louis Pasteur dikisahkan
pernah memisahkan dua enantiomer Natrium Amoium Tartarat menggunakan pinset.
Hal ini dapat terjadi karena dua enantiomer itu mengkristal secara terpisah.
Cara ini sering disebut cara resolusi.
Cara ini kurang efektif karena tidak semua enantiomer mengkristal secara
terpisah.
Jadi resolusi
tidak dapat dianggap sebagai teknik yang umum. Cara lain yang sering ditempuh
para ahli kimia adalah rute biokimia
dengan memakai enzim atau mikroorganisme untuk memproduksi enantiomer murni.
Sebagai contoh (R)-Nikotina dapat diperoleh dengan cara menginkubasi campuran
rasemik (R)-Nikotina dan (S)-Nikotina dalam wadah berisi bakteri Pseudomonas
putida. Bakteri tersebut hanya akan mengoksidasi (S)-Nikotina, sedangkan
(R)-Nikotina akan tersisa dalam wadah tersebut. Beberapa produk lain dari rute
biokimia yaitu Monosodium L-Glutamat, L-Lysine dan L-Mentol. Sistem tata nama D
dan L dinamakan konfigurasi relatif.
Sistem ini sering dipergunakan dalam penamaan asam amino dan karbohidrat.
Sayangnya tidak
semua enantiomer dapat diproduksi dengan EE yang tinggi melalui rute biokimia
ini. Hal ini dikarenakan kespesifikan enzim dan mikroorganisme. Sebagai contoh
bakteri Pseudomonas putida belum tentu dapat digunakan untuk memisahkan
(+)-Mentol dengan (-)-Mentol.
Para ahli kimia
organik seperti Ryoji Noyori dan William S. Knowles tidak kehilangan
akal dalam menyelesaikan permasalahan ini. William S. Knowles berhasil
mensintesis senyawa yang disebut (R,R)-DiPAMP (Gambar 2.). Ia menggunakan
(R,R)-DiPAMP sebagai ligan untuk membentuk senyawa kompleks dengan logam Rh. Senyawa
kompleks ini sangat bermanfaat dalam proses hidrogenasi asimetrik gugus
enamida. Dengan senyawa kompleks ini, ia berhasil mensintesis L-DOPA yang
sangat berguna dalam terapi penyakit Parkinson dengan kemurnian 95 persen ee.
Selain L-DOPA,
senyawa kompleks ini juga sering dipergunakan untuk mensintesis asam?
alfa-amino dengan EE yang tinggi, contoh L-Phenilalanin, L-Trytophan, L-Alanin,
L-Lysin, dan lain-lain, kecuali asam aspartat karena memiliki dua gugus
karboksilat yang berdekatan.
Di lain pihak,
Ryoji Noyori menyintesis senyawa yang diberi nama BINAP. Ia mempergunakan BINAP
sebagai salah satu ligan untuk membentuk senyawa kompleks dengan logam Ru.
Senyawa kompleks ini sangat fleksibel, karena dapat digunakan untuk hidrogenasi
asimetrik alkena, dan reduksi keton secara enantioselective. Sebenarnya proses
reduksi keton secara enantioselective bukanlah hal baru, tetapi penggunaan
logam transisi sebagai katalis untuk proses reduksi keton biasanya sulit dan
tidak bersifat enantioselective. Enantioselective artinya suatu reaksi yang
menghasilkan dua enantiomer, di mana salah satu enantiomer dihasilkan dalam
jumlah yang lebih banyak dibandingkan dengan enantiomer pasangannya.
Khusus untuk
reduksi keton, Ryoji Noyori mensintesis (S)-BINAP/(S)-diamine Ru(II) catalyst.
Dengan senyawa kompleks ini sudah banyak diproduksi obat-obat kiral dengan
biaya produksi yang rendah dan kemurnian yang tinggi. Sebagai contoh L-DOPS,
Levofloxacin, Neobenodine, Fosfomycin, Fluoxetine hydrochloride, Naproxen, dan
lain-lain. Sebagai catatan L-DOPS adalah prekursor dari Norepinephrine.
Norepinephrine adalah neurotransmitter untuk mengirim sinyal ke jantung dan
pembuluh darah.
Kedua penemuan
ini telah membuka cakrawala baru dalam ilmu pengetahuan dan teknologi. Menurut
laporan, sampai tahun 2000, penjualan obat kiral dalam bentuk enantiomer murni
di dunia telah mencapai 123 miliar dolar AS. Tidak tertutup kemungkinan
terwujudnya penemuan-penemuan baru, bahkan mungkin saja bangsa Indonesia yang
akan melakukan terobosan-terobosan baru tersebut. Ingat, kisah ini belum
berakhir, karena ilmu pengetahuan tidak pernah mati. Akhir kata, maju terus
ilmu pengetahuan Indonesia.
Senin, 03 Oktober 2016
RESUME PERTEMUAN KE-6 (STEREOKIMIA)
Stereokimia
adalah susunan ruang dari atom dan gugus fungsi dalam molekul umumnya
molekul organik dalam obyek tiga dimensi yang merupakan hasil hibridisasi dan ikatan secara geometri dari atom dalam molekul. Artinya bagaimana atom-atom dalam sebuah molekul diatur dalam ruang satu terhadap ruang yang lainnya.
molekul organik dalam obyek tiga dimensi yang merupakan hasil hibridisasi dan ikatan secara geometri dari atom dalam molekul. Artinya bagaimana atom-atom dalam sebuah molekul diatur dalam ruang satu terhadap ruang yang lainnya.
Isomeri
adalah gejala atau peristiwa terdapatnya beberapa senyawa berbeda yang
mempunyai rumus molekul sama. Senyawa-senyawa yang berisomeri dikatakan
merupakan isomer satu sama lain. Fenomena terdapatnya tiga senyawa berbeda,
yaitu 1-butanol (CH3 - CH2 - CH2 - CH2
- OH), 2-butanol (CH3 – CH – OH - CH2 - CH3)
dan dietileter (CH3 - CH2 – O - CH2 - CH3)
yang mempunyai rumus molekul sama, yaitu C4H9O, merupakan
gejala isomeri.
Senyawa 1-butanol merupakan isomer
dari senyawa 2-butanol, senyawa 1-butanol juga merupakan isomer dari senyawa
dietileter. Apakah 2-butanol merupakan isomer dari dietil eter? Tentu iya,
senyawa 1-butanol, 2-butanol dan dietileter merupakan isomer satu sama lain.
Oleh karena itu, isomer adalah suatu senyawa dari beberapa senyawa yang
mempunyai rumus molekul sama, tetapi mempunyai sifat berbeda akibat perbedaan
susunan atom-atomnya.
Dengan kata lain, isomer adalah suatu senyawa dari beberapa
senyawa berbeda yang mempunyai rumus molekul sama. Kata isomer berasal
dari kata Latin isomeres yang berarti mempunyai bagian yang sama. Isomeres
sendiri merupakan gabungan dari kata iso yang artinya sama, dan meros
yang artinya adalah bagian.
Perhatikan dua
senyawa berikut:
Kedua senyawa tersebut jelas
merupakan senyawa yang berbeda, hal tersebut diketahui dari struktur dan sifat
kedua senyawa yang berbeda. Senyawa 1-butena merupakan senyawa dengan rantai
karbon terbuka dan mempunyai gugus fungsi berupa ikatan rangkap dua, sedangkan
siklobutana merupakan senyawa dengan rantai karbon tertutup atau siklis dan
tidak mempunyai ikatan rangkap dua. Senyawa 1-butena berwujud gas pada suhu
kamar, karena mempunyai titik didih- 5oC, sedangkan siklobutana berwujud gas,
atau dapat berupa cairan pada daerah bersuhu rendah (yaitu yang mempunyai suhu
kamar kurang dari 13oC). Senyawa 1- butena mempunyai rumus molekul C4H8,
dan siklobutana juga mempunyai rumus molekul sama, C4H8. Karena
kedua senyawa merupakan senyawa berbeda tetapi mempunyai rumus molekul sama,
maka 1-butena dan siklobutana berisomeri.
Adakah senyawa lain selain 1-butena
dan siklobutana yang mempunyai rumus molekul C4H8? Apakah
2-butena merupakan isomer dari 1-butena dan siklobutana? Struktur 2-butena
adalah CH3CH = CHCH3. Senyawa ini berbeda dengan 1-butena
karena letak ikatan rangkap duanya berbeda, dan berbeda dengan siklobutana
karena rantai karbonnya terbuka, sedangkan siklobutana tertutup. Akan tetapi,
2-butena mempunyai rumus molekul yang sama dengan 1-butena atau siklobutana,
yaitu C4H8. Dengan demikian 2-butena adalah isomer dari
1- butena dan siklobutana.
Dapatkah Anda menemukan isomer lain
yang mempunyai rumus molekul C4H8? Bila jawaban Anda ya, tunjukkan struktur dan
nama dari isomer-isomer tersebut ? Dengan demikian, terdapat berapa isomer yang
mempunyai rumus molekul C4H8 ? Akan tetapi, bila jawaban Anda tidak terdapat
senyawa lain yang mempunyai rumus molekul C4H8, selain 1-butena, 2-butena, dan
siklobutana, pertimbangkanlah beberapa senyawa berikut:
Bila diperhatikan lebih lanjut,
ternyata terdapat dua jenis 2-butena, yaitu :
Cis-2-butena dan trans-2-butena
berbeda dalam susunan gugus atau atom yang terikat pada karbon ikatan rangkap,
pada cis-2-butena gugus-gugus metil terikat pada sisi ikatan rangkap yang sama,
sedangkan pada trans-2-butena gugus-gugus metil terikat pada sisi ikatan
rangkap yang bersebrangan. Perbedaan struktur keduanya menyebabkan sifat
keduanya juga berbeda, salah satunya dapat ditunjukkan dari titik didih
cis-2-butena dan trans-2-butena yang berbeda. Dengan demikian, cis-2- butena
dan trans 2-butena merupakan isomer satu sama lain.
Suatu molekul dapat bergerak dalam
ruang, menekuk atau membelit sehingga dapat digambarkan dengan beberapa cara
yang berbeda. Oleh karena itu, perlu kehati-hatian untuk menentukan apakah
suatu struktur merupakan isomer dari struktur yang lain, atau merupakan senyawa
yang identik. Perhatikanlah struktur-struktur di bawah ini, setiap baris
struktur yang ditunjukkan bukan merupakan isomeri, tetapi merupakan senyawa
identik.
Jenis-jenis
Isomeri
Senyawa-senyawa yang berisomeri
adalah senyawa-senyawa yang berbeda satu sama lain, dan perbedaannya disebabkan
oleh cara penyusunan atom-atomnya. Terdapat dua jenis isomeri, yaitu isomeri struktur dan stereoisomeri. Isomeri struktur adalah isomeri dengan
perbedaan terletak pada urutan penggabungan atom-atom yang menyusun molekul,
sedangkan stereoisomeri adalah isomeri dengan perbedaan terletak pada cara
penataan atom-atom dalam ruang, tetapi urutan penggabungan atom-atomnya tidak
berbeda. Sebagai contoh 1-butanol dan 2-butanol adalah isomer struktur,
karena urutan penggabungan atom oksigen dari gugus hidroksil (gugus OH) pada
rangka karbonnya berbeda. Akan tetapi, R-2-butanol dan S-2-butanol adalah dua
senyawa yang berstereoisomeri, keduanya mempunyai urutan penggabungan atom-atom
yang sama, tetapi penataan ruang atom-atom pada atom karbon nomor 2 tidak sama,
yang menyebabkan R-2-butanol dan S-2-butanol mempunyai sifat berbeda, yaitu
memutar bidang cahaya
terpolarisasi pada polarimeter ke arah yang berbeda.
Stereoisomeri merupakan peristiwa
terdapatnya beberapa senyawa berbeda dengan rumus molekul sama, dan perbedaan antara senyawa-senyawa tersebut
terletak pada cara penataan atom-atom dalam ruang, tetapi urutan penggabungan
atom-atomnya tidak berbeda. Terdapat berbagai jenis
stereoisomeri, yaitu isomeri geometri
(atau isomeri cis-trans),
dan isomeri konfigurasi.
Isomeri
Geometri
Isomeri geometri terdapat pada
senyawa-senyawa alkena yang pada setiap atom karbon ikatan rangkapnya mengikat
dua gugus yang berbeda. Isomeri
geometri didefinisikan sebagai peristiwa terdapatnya beberapa senyawa berbeda
yang mempunyai rumus molekul sama, dan perbedaan di antara senyawa-senyawa
tersebut terletak pada cara penataan gugus-gugus di sekitar ikatan rangkap.
Isomeri ini hanya ditemukan pada senyawa-senyawa yang berikatan tegar atau
rigid, sehingga tidak dapat berotasi, seperti alkena dan sikloalkana.
Isomeri geometri dapat terjadi
karena terdapat perbedaan penataan ruang gugus-gugus di sekitar ikatan rangkap
dua suatu alkena atau di sekitar dua karbon anggota cincin suatu sikloalkana.
Dua gugus yang terletak pada satu sisi yang sama, disebut cis (dari
Bahasa Latin, yang artinya pada sisi yang sama), sedangkan dua gugus yang
terletak pada sisi-sisi yang berlawanan disebut trans (dari Bahasa Latin, artinya bersebrangan).
Contoh isomeri
geometri adalah cis-1,2-dibromoetena dan trans-1,2- dibromoetena.
Keduanya merupakan dua senyawa berbeda, salah satunya dibuktikan dari perbedaan
titik didihnya. Urutan penggabungan atom-atom kedua senyawa tersebut sama,
tetapi penataan ruang atom-atom di sekitar ikatan rangkapnya berbeda, jadi
keduanya tidak termasuk isomeri struktur, tetapi stereoisomeri, khususnya
isomeri geometri. Perbedaan nama keduanya ditunjukkan dengan awalan cis dan
trans. Awalan cis digunakan untuk memberi nama alkena dengan dua
gugus pada kedua karbon berikatan rangkap terletak pada sisi yang sama.
Sebaliknya, awalan trans digunakan untuk memberi nama alkena dengan dua
gugus pada kedua karbon berikatan rangkap terletak pada sisi yang bersebrangan.
Persyaratan isomeri geometri adalah
tiap karbon yang terlibat dalam ikatan rangkap harus mengikat dua gugus yang
berlainan, misalnya H dan F, atau CH3 dan CH2CH3. Jika
salah satu karbon atau kedua karbon yang berikatan rangkap mengikat dua gugus
yang identik, misalnya dua atom Br atau dua gugus CH3, maka tak mungkin terjadi
isomeri geometri. Perhatikan bahwa pada contoh-contoh di bawah ini tidak
mungkin ditemukan isomeri geometri.
Isomeri geometri atau isomeri cis-trans
dapat ditemukan juga pada senyawa siklik berikatan tunggal atau
sikloalkana. Seperti juga pada ikatan rangkap, ikatan tunggal pada suatu
struktur cincin tidak dapat berotasi bebas. Oleh karena itu, bila terdapat dua
atom karbon anggota cincin yang masing-masing mengikat dua gugus berbeda selain
atom karbon anggota cincin, maka akan ditemukan isomeri geometri. Struktur cis,
bila gugus-gugus pada dua atom karbon cincin tersebut terletak pada sisi yang
sama dari bidang cincin, sebaliknya bila gugus-gugus pada dua atom karbon
cincin terletak pada sisi yang berlawanan dari bidang cincin, maka bentuk
struktur tersebut adalah trans.
Tampak pada cis-1,2-dikloroetana,
kedua gugus Cl terletak pada sisi yang sama dari ikatan rangkap. Bila kedua
gugus Cl berada pada posisi bersebrangan dari ikatan rangkap, maka terbentuk trans-1,2-dikloroetana.
Senyawa cis dan trans-1,2-dikloroetana merupakan dua senyawa yang
berbeda, seperti terlihat dari perbedaan titik didihnya.
Penamaan cis-trans pada
alkena dapat dilakukan bila pada kedua karbon berikatan tegar terdapat dua
gugus yang sama. Bila atom-atom karbon berikatan tegar mengikat empat gugus
yang berbeda, maka akan sulit untuk memberikan penamaan cis atau trans.
Perhatikan struktur di bawah ini, apakah merupakan struktur cis atau trans
?
Pada sistem seperti ini, tidak dapat
digunakan sistem penamaan cis-trans, akan tetapi harus digunakan sistem
penamaan yang lebih umum, yaitu sistem (E) dan (Z). Huruf E
berasal dari kata Bahasa Jerman “entgegen” yang berarti
bersebrangan, sedangkan huruf Z berasal dari kata Bahasa Jerman “zusammen”
yang artinya bersama-sama.
Sistem (E) dan (Z)
didasarkan pada pemberian prioritas kepada atom atau gugus yang terikat pada setiap
karbon ikatan rangkap. Jika kedua gugus berprioritas lebih tinggi terletak pada
sisi yang berlawanan, maka isomer itu adalah (E). Sebaliknya, bila kedua
gugus berprioritas tinggi terletak pada sisi yang sama, maka isomer iitu adalah
(Z). Secara sederhana ketentuan tersebut dapat dinyatakan dengan
Aturan
Penentuan Prioritas
1. Prioritas
ditentukan oleh nomor atom dari atom yang berikatan langsung dengan atom-atom
karbon ikatan rangkap. Nomor atom yang lebih tinggi mempunyai prioritas yang lebih
tinggi.
2. Jika
atom-atom yang terikat sama, maka yang digunakan sebagai dasar adalah atom yang
terikat berikutnya sampai diperoleh perbedaan prioritas. Dalam contoh berikut
ditunjukkan nomor atom yang dijadikan dasar penentuan prioritas.
3. Atom-atom
yang terikat oleh ikatan rangkap dua atau rangkap tiga dianggap mengikat dua
atau tiga atom sejenis dengan ikatan tunggal. Tiap atom berikatan rangkap dua
didua-kalikan dan berikatan rangkap tiga, di tiga-kali-kan.
Perhatikan contoh sistem
penamaan alkena dengan sistem (E) dan (Z) berikut:
Isomeri
Konfigurasi
Jenis
stereoisomeri yang lain adalah isomeri konfigurasi atau isomer optis. Isomeri
konfigurasi terjadi pada molekul yang tidak mempunyai bidang simetri. Bidang
simetri adalah bidang imajiner yang membagi molekul menjadi dua bagian yang
satu sama lain adalah bayangan cerminnya. Molekul yang tidak mempunyai bidang
simetri akan berinteraksi dengan bidang cahaya terpolarisasi sehingga bidang
cahaya terpolarisasi akan berputar, baik ke kiri atau ke kanan. Kemampuan
memutar bidang cahaya terpolarisasi tersebut, baik arah maupun besar sudut
putarnya dapat diketahui dengan alat polarimeter. Salah satu ciri molekul yang
tidak mempunyai bidang simetri adalah pada molekul tersebut terdapat atom
karbon yang mengikat empat gugus berbeda. Atom karbon seperti itu disebut atom karbon kiral atau asimetris, yaitu
atom karbon yang mengikat 4 (empat) gugus berbeda. Cara penataan 4 (empat)
gugus berbeda pada suatu atom karbon kiral disebut konfigurasi. Oleh karena
itu, peristiwa terdapatnya beberapa senyawa berbeda yang mempunyai rumus
molekul sama, dan perbedaannya terletak pada konfigurasi atom karbon kiral
(penataan empat gugus berbeda di sekitar atom karbon kiral) disebut isomer konfigurasi.. Sebagai contoh,
atom karbon nomor 3 pada molekul 3-kloro-2-metilpentana adalah atom karbon
kiral, karena mengikat empat gugus berbeda, yaitu H, CH2CH3, Cl, dan CH(CH3)2.
Atom karbon kiral atau pusat kiral seringkali diberi tanda *. atom karbon kiral
atau asimetris.
Senin, 26 September 2016
RESUME KE-5 (ISOMERI STRUKTUR SENYAWA HIDROKARBON DAN SISTEM NOMENKLATUR MENURUT IUPAC)
RESUME KE-5 (ISOMERI STRUKTUR
SENYAWA HIDROKARBON DAN SISTEM NOMENKLATUR MENURUT IUPAC)
Aturan Dasar
Tata Nama Senyawa Organik berdasarkan IUPAC
A. Senyawa-Senyawa
Alkana
Senyawa-senyawa alkana, dengan rantai lurus karbon tanpa
ikatan rangkap, diberi nama berdasarkan jumlah atom karbon dalam rantai
terpanjang.
|
Jumlah atom C
|
Nama
|
|
1
|
Metana
|
|
2
|
Etana
|
|
3
|
Propana
|
|
4
|
Butana
|
|
5
|
Pentana
|
|
6
|
Heksana
|
|
7
|
Heptana
|
|
8
|
Oktana
|
|
9
|
Nonana
|
|
10
|
Dekana
|
|
11
|
Undekana
|
|
12
|
Dodekana
|
|
13
|
Tridekana
|
|
15
|
Pentadekana
|
|
18
|
Oktadekana
|
|
20
|
Ikosana
|
|
21
|
Heneikosana
|
|
22
|
Dokosana
|
|
23
|
Trikosana
|
|
30
|
Trikontana
|
|
40
|
Tetrakontana
|
|
50
|
Pentakontana
|
|
70
|
Heptakontana
|
|
90
|
Nonakontana
|
|
100
|
Hentana
|
|
|
Contoh:
|
|
B.
Senyawa Senyawa Alkena
Bila
dalam rantai lurus senyawa karbon terdapat satu atau lebih ikatan rangkap dua,
senyawa tersebut disebuk alkena. Penamaan senyawa alkena sama seperti dengan
senyawa alkana, dengan akhiran –ana diganti menjadi – ena, seperti propena,
heptena, dst. Ikatan rangkap diberi
nomor sesuai letaknya terhadap ujung rantai terdekat. Nomor ikatan rangkap
diatur menjadi nomor paling kecil.
|
|
C.
Senyawa-senyawa Alkuna
Bila
dalam rantai lurus senyawa karbon dapat terdapat satu atau lebih ikatan rangkap
tiga, senyawa tersebut disebut alkuna. Aturan penamaan Alkuna sama seperti
Alkena, hanya saja akhiran –ena diganti menjadi –una.
|
|
D.
Senyawa-senyawa Alkanol
Bila
dalam rantai lurus senyawa Alkana terdapat gugus fungsi –OH, senyawa tersebut
disebut Alkanol atau Alkohol. Nama untuk senyawa Alkanol sama dengan penamaan
untuk senyawa alkana, dengan akhiran –a diganti menjadi –ol. Gugus fungsi –ol diberi nomor sesuai letaknya
terhadap ujung rantai terdekat. Nomor gugus fungsi diatur menjadi nomor paling
kecil.
E.
Senyawa-senyawa Eter
Suatu
senyawa karbon disebut sebagai eter apabila di dalam rantai karbonnya terdapat
gugus - O -. Merupakan isomer fungsi dari alkohol. Senyawa eter diberi nama
mengikuti nama-nama gugus alkil yang terikat pada gugus fungsi - O - ,
nama-nama alkil tersebut disusun secara alfabetis dan diberi akhiran “eter”.
F.
Senyawa-senyawa Aldehid
Senyawa
aldehid adalah suatu rantai karbon yang mengandung gugus fungsi karbonil dengan
salah satu dan/atau kedua R dapat diganti dengan gugus alkil atau atom
hydrogen. Aturan penamaan aldehid sama dengan aturan penamaan alcohol, dengan
akhiran –ol diganti dengan –al.
G.
Senyawa-senyawa Keton
Merupakan
isomer fungsi dari aldehid.Sama dengan aldehid, hanya saja pada keton, kedua R
merepresentasikan gugus alkil, bukan suatu atom hidrogen. Aturan penamaan keton
sama dengan aturan penamaan aldehid, dengan akhiran –al diganti dengan –on.
H.
Senyawa-senyawa Asam Karboksilat
Sama
seperti aldehid dan keton, asam karboksilat juga memiliki gugus karbonil, atom
O yang berikatan rangkap dengan karbon. Gugus karbonil pada asam karboksilat
berikatan lagi dengan gugus hidroksil (-OH) , disebut pula sebagai gugus
karboksilat, dan memiliki rumus dasar R-COOH
Penamaan asam karboksilat dibuat dengan cara menentukan rantai karbon
terpanjang (dan mengandung gugus karboksilat). Sistem penamaan sama dengan
penamaan alkana dengan mengganti akhiran –a dengan –oat dan ditambah “asam” di
depannya. Apabila mengandung cabang alkil, nomor cabang alkil dihitung dari
letaknya terhadap atom C yang mengandung gugus karboksilat.
I. Senyawa-senyawa
Ester
Ester merupakan hasil reaksi antara suatu asam karboksilat
dengan suatu alkohol. Selain itu Ester juga merupakan isomer fungsi dari asam
karboksilat. Ester memiliki rumus dasar R-COO-R’, dengan alkil R berasal dari
reagen asam karboksilat dan alkil R’ berasal dari reagen alkohol.
Isomer Hidrokarbon
Isomer hidrokarbon
artinya kumpulan hidrokarbon yang mempunyai rumus mulekul yang sama namun
berbeda bentuk/strukturnya. Jenis isomer ada 2 yakni isomer struktur dan isomer
geometri.....kemudian isomer struktur dibagi lagi menjadi 2 yakni isomer
kerangka dan isomer fungsi. Demikian juga dengan isomer
geometri, juga dibagi lagi menjadi 2 yakni isomer optik aktif dan isomer
cis-trans.
A. Isomer Struktur
Isomer struktur
disebabkan perbedaan ikatan antar unsur-unsur penyusunnya sehingga mempunyai
bentuk yang berbeda sebagai contoh akan saya sebutkan isomer dari C6H14 (alkana),
dalam menggambarkan isomer dari C6H14 hanya
akan saya tulis ikatan antar atom C nya saja sedangkan atom H nya dapat kita
tambahkan setelah suluruh isomer tergambar dengan ketentuan :
tanda ( - ) menunjukkan
ikatan atom C tersebut dengan atom C lainnya jadi banyaknya tanda ( - )
menunjukkan banyaknya atom C lainnya yang diikat karena jumlah ikatan dalam
atom C maksimal 4 ikatan maka jumlah atom H yang diikat dapat ditentukan bila
hanya terdiri dari satu tanda ( - ) maka atom C tersebut terletak di tepi dan
mengikat 3 atom H bila terdiri dari 2 tanda ( - ) berarti atom C ersebut terletak
diantara rantai lurus dan mengikat 2 atom H. Bila terdiri dari 3 tanda ( - )
berarti atom C tersebut terletak pada percabangan yang berbentuk pertigaan dan
mengikat 1 atom H. Dan bila terdiri dari 4 tanda ( - ) berarti atom C persebut
terletak pada percabangan yang berbentuk perempatan dan juga berarti tidak ada
ikatan dengan atom H karena jumlah ikatan maksimal yakni 4 ikatan, sudah
terpenuhi kembali lagi dalam penggambaran isomer dari alkana dengan rumus
molekul C6H14, yaitu agar
dalam penggambaran
isomer di atas, tidak ada bentuk yang terlewatkan . Isomer dari Alkena
dengan rumus molekul C6H12, yakni
B.
Penggolongan Isomer Struktur
Untuk Alkena dan Alkuna karena mempunyai gugus
fungsi ikatan rangkap 2 atau 3 maka bentuk isomer strukturnya dapat digolongkan
lagi dalam dua jenis
1.
Isomer kerangka
Isomer struktur yang
mempunyai letak ikatan rangkap yang sama namun bentuk kerangka bangunnya
berbeda. misalnya
2.
Isomer Fungsi
Isomer struktur yang
mempunyai bentuk kerangka yang sama namun ikatan rangkapnya berbeda. misalnya
C. Isomer Geometri
Isomer geometri disebabkan
oleh susunan atom dalam ruang. Jadi bila ada 2 senyawa hidrokarbon yang bentuk
strukturnya sama, baik kerangkanya maupun letak gugus fungsionalnya sama, masih
mungkin berbeda jenis jika susunan atom dalam ruangnya berbeda.
D. ISOMER CIS-TRANS
Syarat utama terbentuk isomer
Cis-Trans adalah terdapat ikatan rangkap dua ( C=C) yang tiap-tiap karbon (C)
dalam ikatan rangkap tersebut mengikat atom atau gugus atom yang berbeda. Untuk membedakan Alkena yang mempunyai isomer Cis-Trans atau tidak,
perhatikanlah dua contoh senyawa di bawah ini :
1.
CH2=CHCH3 ( n-propena) bila digambarkan bentuk
strukturnya secara lengkap akan tampak sebagai berikut :
Coba
kalian perhatikan bentuk di atas, atom karbon yang tepat berada di sebelah
kanan ikatan rangkap selain mengikat C dengan ikatan rangkap juga
mengikat 2 gugus yang berbeda yaitu - CH3 dan - H.
Sedangkan atom karbon yang tepat berada di sebelah kiri ikatan rangkap mengikat
2 gugus yang sama yaitu - H. karena gugus yang diikat sama maka senyawa
ini tidak mempunyai isomer Cis-Trans.
2.
CH3CH=CHCH3 ( 2-butena) bila digambarkan bentuk strukturnya
secara lengkap akan tampak seperti ini :
Kedua
atom karbon yang mengikat ikatan rangkap tiap-tiap karbonnya baik yang sebelah
kiri maupun yang sebelah kanan ikatan rangkap mempunyai dua gugus yang berbeda yaitu
-CH3 dan H jadi perlu diperhatikan di sini, yang dimaksud
mengikat gugus yang berbeda adalah pada tiap-tiap karbon yang
berikatan rangkap.
Jadi bentuk senyawa di atas mempunyai isomer
Cis-Trans yang digambarkan sebagai berikut
Bila
gugus yang sama dalam kedua karbon yang berikatan rangkap ( C=C ) terletak
dalam satu sisi disebut Cis, sedangkan bila gugus yang sama dalam kedua karbon
yang berikatan rangkap terletak berseberangan disebut trans.
E. ISOMER OPTIS AKTIF
Isomer
ini terbentuk karena adanya atom C kiral. C kiral adalah atom karbon yang
mengikat 4 gugus yang berbeda. Coba kalian perhatikan gambar di bawah ini
:
Pada
gambar di atas terdapat C kiral, yakni yang diberi warna merah. Atom C tersebut
mengikat 4 gugus yang berbeda, yakni atom hidrogen (H), metil (CH3-), etil (CH3-CH2-)
dan propil (CH3-CH2-CH2-) untuk memahami isomer ini dibutuhkan model 3 dimensi
misalnya tangan kita. Walaupun bagian
tangan kanan dan kiri kita sama namun secara keseluruhan berbeda tangan kiri
dan kanan satu sama lainnya ibarat bayangan cermin.
Langganan:
Komentar (Atom)